日前,江西3L集团生产的医用外科口罩在美国FDA 510(K)获得登记注册。这是3L集团公司继一次性使用医用口罩、医用防护口罩(N95)之后,我公司又一类口罩产品获准美国FDA注册!


美国FDA对于医用外科口罩的技术要求
医用外科口罩主要构成部件包括口罩主体,鼻梁条,耳挂。其中口罩主体一般由三层构成,分别是外层无纺布、里层无纺布以及中间的过滤层。过滤层通常用熔喷布材料制成。
美国FDA对于医用外科口罩的技术要求通常包括两大方面,一个是产品本身的各种过滤和防护性能。另一方面就是所有的材料的生物相容性。
1、 产品过滤和防护性能
1) 防液体喷溅穿透能力;
2) 微粒过滤效率PFE;
3) 细菌过滤效率BFE;
4) 呼吸阻抗Delta P测试;
5) 易燃性指标。
2、 材料的生物相容性
生物相容性是材料安全性的关键指标,通常和人体完好皮肤接触的产品仅需要测试细胞毒性、致敏和皮肤刺激三个指标。但是对于口罩各个不同结构部分,由于其材料不一样,有无纺布、有橡筋耳挂,有塑料或金属鼻梁条,都需要分开测试以提供安全性的证据。如果口罩的颜色不一样,生物相容性测试也需要分开进行,因为不同的色素可能会导致不一样的生物相容性。
美国FDA对医用外科口罩的主要技术要求除上述外,还包括诸如产品的外观、尺寸、灭菌状态及标签的要求等。

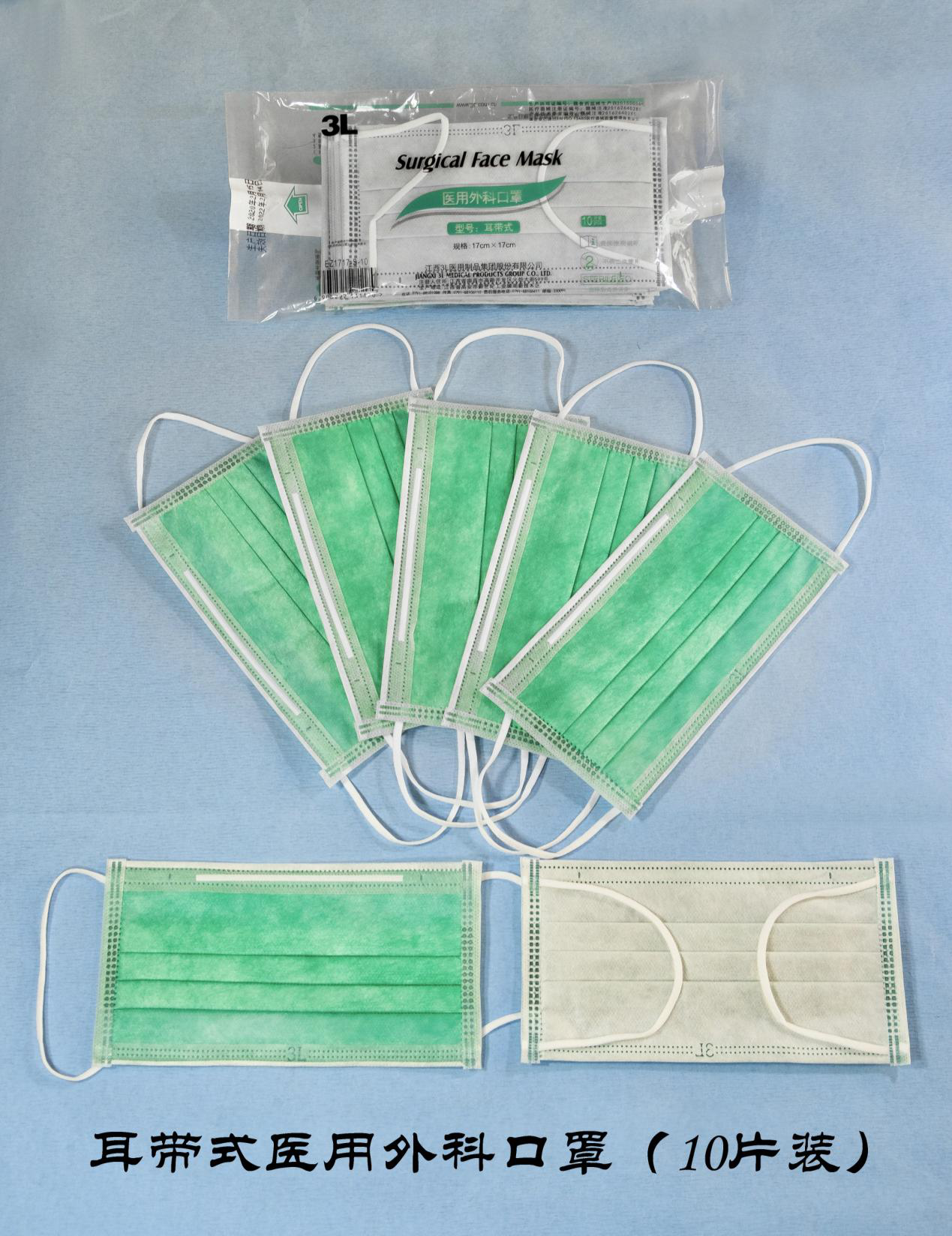
3L集团始终坚持把科技创新作为引领企业发展的动力,早在十多年前就在国内率先研发熔喷无纺布医用外科口罩,在甲、乙型流感、非典、禽流感以及今年的新冠肺炎疫情等特殊时期做出过卓绝贡献。